生体分子群はお互いに物理的および機能的に相互作用し、多彩な化学反応を引き起こすことにより、多様で柔軟な生命現象を構築しています。当研究室では、機能未知の生体分子の中でも生体膜に発現する膜タンパク質に主に注目し、その生理機能の解明により新たな創薬標的分子の同定を目指す生命薬学研究を展開しています。 できるだけin vivoでの生命現象の観察を出発点とし、その分子メカニズムの解明を目指して以下の研究を行っています。
Biomolecules interact physically and functionally, driving diverse chemical reactions that underpin complex biological phenomena. Our laboratory focuses on membrane proteins, particularly those with unknown physiological functions, aiming to identify novel drug targets through life pharmaceutical research. We primarily observe biological phenomena in vivo and investigate their molecular mechanisms.
1. 細胞内Ca2+制御に関わる膜タンパク質の生理機能解析
Physiological Functions of Membrane Proteins in Intracellular Ca2+ Regulation
細胞内Ca2+は極めて重要なシグナル分子であり、筋収縮、神経伝達物質やホルモン分泌など広範かつ重要な生理機能の制御を担っています。一方で、細胞内Ca2+動態や制御分子機構、生理機能との関連は未知のまま多く残されています。そのため、様々な細胞種における細胞内Ca2+動態やその制御機構を明らかにすることは、それぞれの細胞における特徴的な生理機能を理解する上で非常に重要です。細胞内Ca2+濃度の変化は細胞膜及び小胞体膜のイオンチャネルや受容体などの分子で制御されており、細胞外の情報を細胞内へ伝達し、遺伝子発現などの多様な生理的応答へと変換します。そこで、未解明のCa2+動態とその制御機構を探索し、生理機能との関連を調べる研究を行っています。これまでに、小胞体膜に分布し小胞体Ca2+ストア放出を補助するTric-b遺伝子の欠損によって引き起こされる骨形成不全症や低身長の病態分子機序を解明しました ( Sci Signal., 2016, Cell Death Dis., 2023, 図1)。
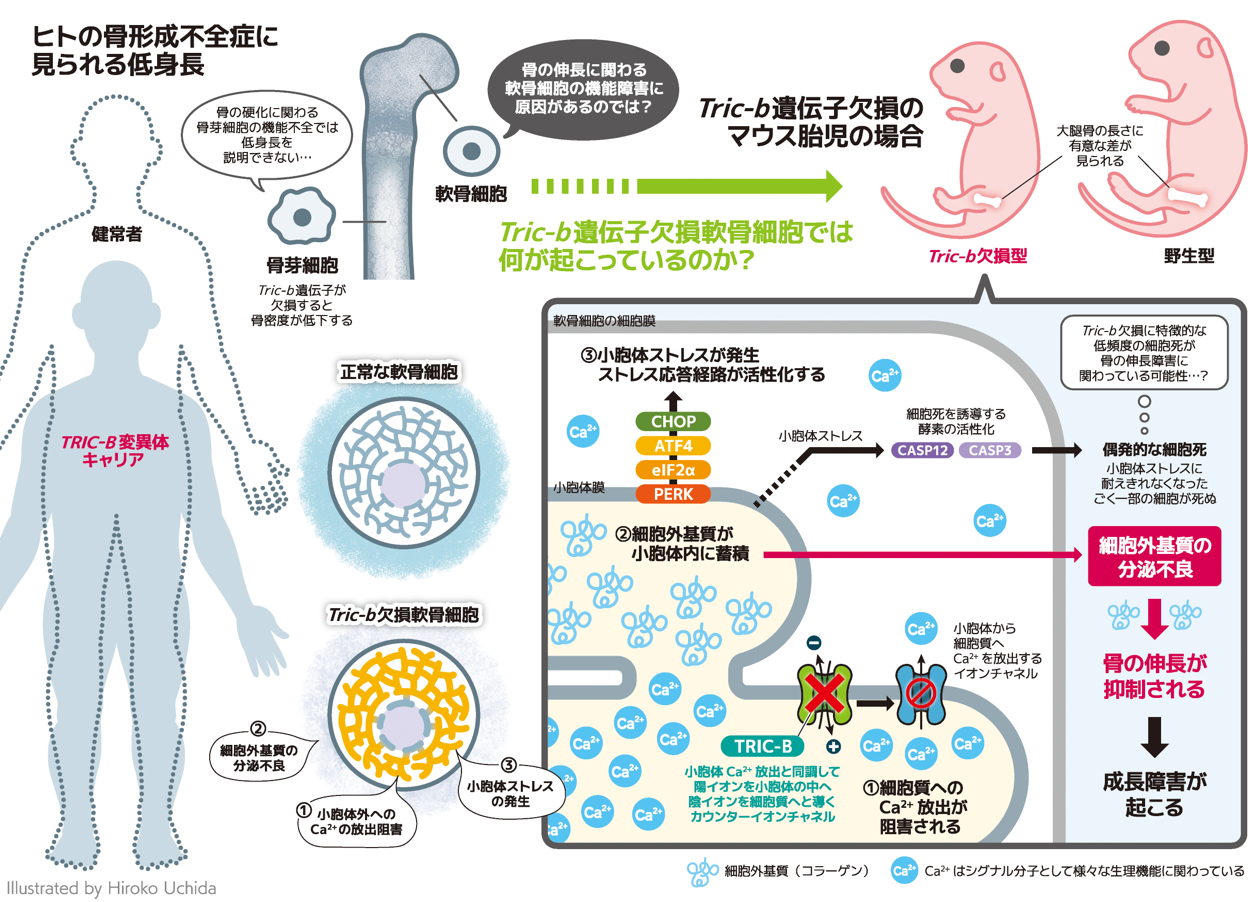
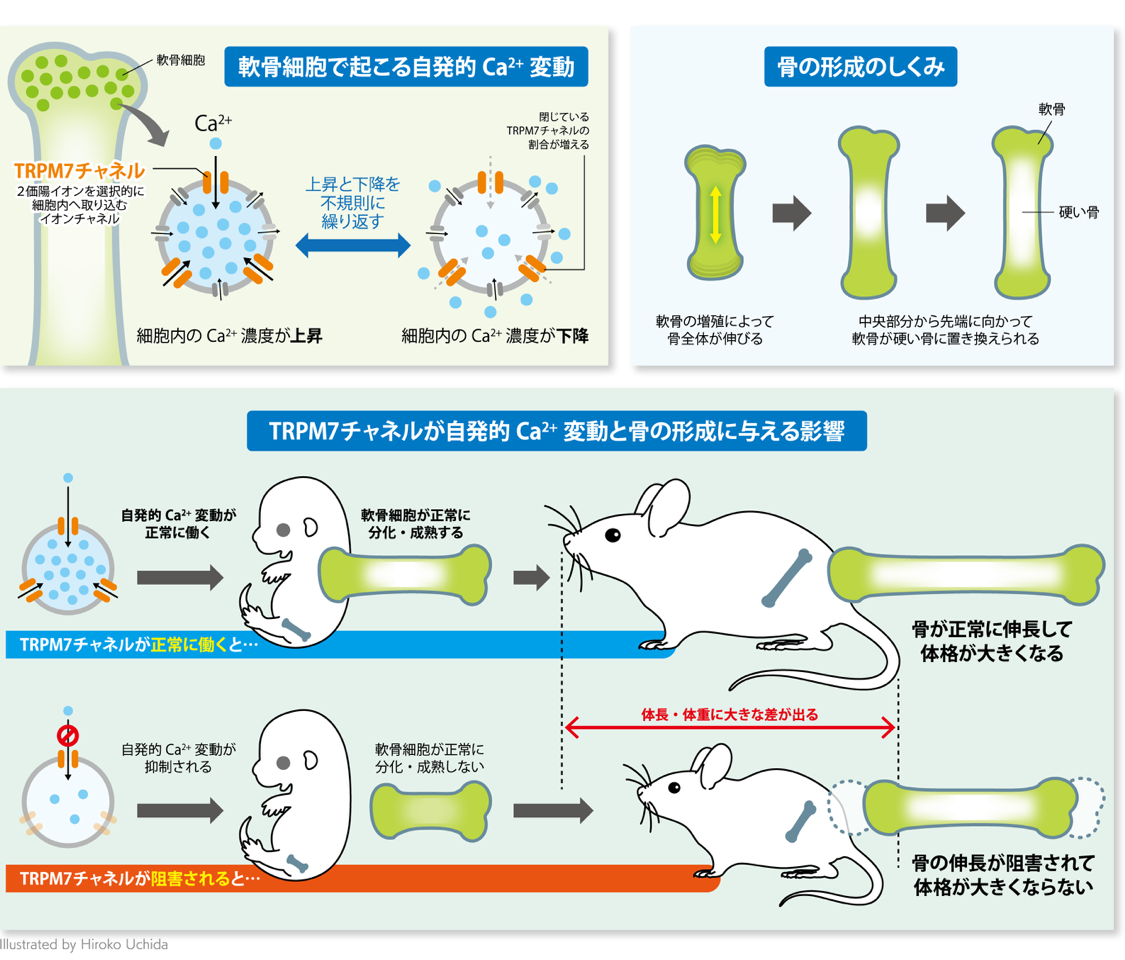
また、正常な軟骨細胞内Ca2+制御に関わるTRPM7を中核としたシグナル分子機序を解明し (Sci Signal., 2019, 図2)、C型ナトリウム利尿ペプチドによる細胞内Ca2+シグナル活性化経路を同定しました (eLife., 2022)。骨でのさらなる細胞内Ca2+シグナル制御分子を探索するとともに、骨で得られた知見に基づき、肝細胞やがん細胞など他の種類の細胞での役割の解明も目指して研究を展開しています。
Intracellular Ca2+ is a crucial signaling molecule that regulates muscle contraction, neurotransmitter release, and hormone secretion. However, its dynamics, regulatory mechanisms, and physiological roles remain poorly understood across various cell types. We investigate these mechanisms by analyzing ion channels and receptors on the plasma and endoplasmic reticulum membranes (Sci Signal., 2016; Sci Signal., 2019; eLife, 2022; Cell Death Dis., 2023).
2. 細胞内Ca2+の薬理学的調節による新たな疾患治療法の探索
Pharmacological Modulation of Intracellular Ca2+ for Disease Treatment
独自に明らかにした細胞内シグナル経路に基づいて、薬理学的に細胞内Ca2+シグナルを調節することにより、疾患治療に結びつくような生理機能の制御を行うことを目指しています。イオンチャネルや受容体を直接刺激するだけでなく、シグナル経路が理解されていれば、経路下流の酵素の活性調節によっても細胞内Ca2+シグナルを摂動することができます。堅実な基礎研究に立脚することで、これまでにない治療戦略を提案できると信じて研究しています。
Based on our discoveries in Ca2+ signaling pathways, we explore pharmacological strategies to regulate intracellular Ca2+ for therapeutic applications. By targeting ion channels and receptors, as well as downstream molecules such as enzymes, we aim to develop innovative treatment strategies grounded in rigorous fundamental research.
3. 遺伝子改変マウスを用いた機能未知分子の生理機能解析
Functional Analysis of Unknown Molecules Using Genetically Modified Mice
遺伝子改変マウスの表現型を詳しく調べることで、その分子の生理機能を明らかにすることができます。例えば、食事中に含まれる脂肪酸をリガンドとする脂肪酸受容体GPR120がマウスだけでなくヒトでも肥満に関与することをこれまでに発見しました (Nature, 2012)。全身で遺伝子欠損すると胎生致死を示す場合でも、部位や時期特異的に欠損することで表現型を解析可能となる場合があります (Sci Signal., 2019)。これまでの研究から注目するに至った受容体やイオンチャネルはもちろん、メチル化RNAとその翻訳調節に関与する遺伝子群など、国内外での共同研究も含めて機能未知分子の生理機能を解明するべく複数の遺伝子改変マウスの作出と表現型解析を推進しています。
By analyzing the phenotypes of genetically modified mice, we aim to elucidate the physiological roles of various genes. For example, we previously discovered that the fatty acid receptor GPR120 is involved in obesity in both mice and humans (Nature, 2012). Even in cases where global gene knockout results in embryonic lethality, tissue- and time-specific deletions can provide valuable insights (Sci Signal., 2019). In addition to membrane proteins, we are also investigating other gene families, such as those involved in RNA methylation, through international collaborations using genetically modified mouse models.